产品属性
基因敲除细胞 :
基因敲除技术,可精准地去除或失活特定基因。构建基因敲除的细胞模型,可揭示基因在生物体中的功能,并在药物靶点筛选、药物开发等领域有广泛的应用。现有的基因编辑工具有CRISPR/Cas9、TALENs或ZFNs等。目前,CRISPR/Cas9系统因其高效性和操作便捷性,已成为基因敲除的首选工具。该系统通过gRNA引导Cas9核酸酶,对目标DNA进行特异性的识别和切割,产生DNA双链断裂(DSB)。随后,细胞通过非同源末端连接(NHEJ)途径修复这些双链断裂。在修复过程中,常常会产生非三倍数的插入或缺失(indel),导致移码突变,进而实现基因敲除。
服务详情
服务类型 :单基因敲除/多基因敲除/移码突变/片段敲除
交付标准 :基因敲除单克隆细胞≥1株(2管细胞/株,1×106/管)
艾迪基因基于自主研发的EditXTM基因编辑平台,采用优化升级的CRISPR/Cas9系统,可根据基因与细胞、实验目的,制定合适的敲除策略和方案,可高效地构建符合需求的基因敲除细胞模型。
服务优势:
服务类型
可根据客户需求、并综合基因和细胞等情况,设计基因敲除方案。
单基因敲除 :实现单个基因的有效敲除
多基因敲除 :实现多个基因的有效敲除
移码突变 : 针对编码基因的编码区前端设计sgRNA,实现碱基非3的倍数的indel
片段敲除 : 针对基因设计sgRNA,实现基因片段的删除
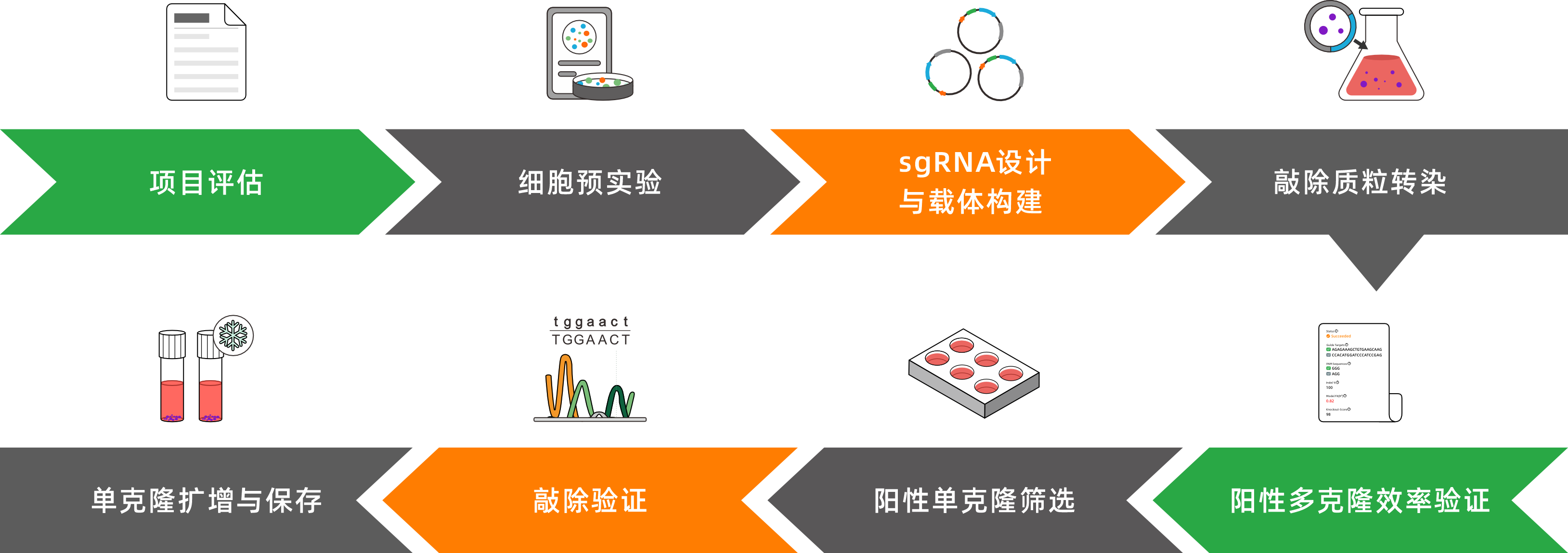
服务流程
1.慢病毒法
2.质粒法
成功案例
艾迪基因根据客户需求,综合靶基因和细胞的情况,针对性地设计了基因敲除方案。
● 在huh6 细胞中实现A基因的片段删除
1. 敲除方案
在huh6 细胞中,针对A基因的编码区设计两条sgRNA,实现片段敲除。
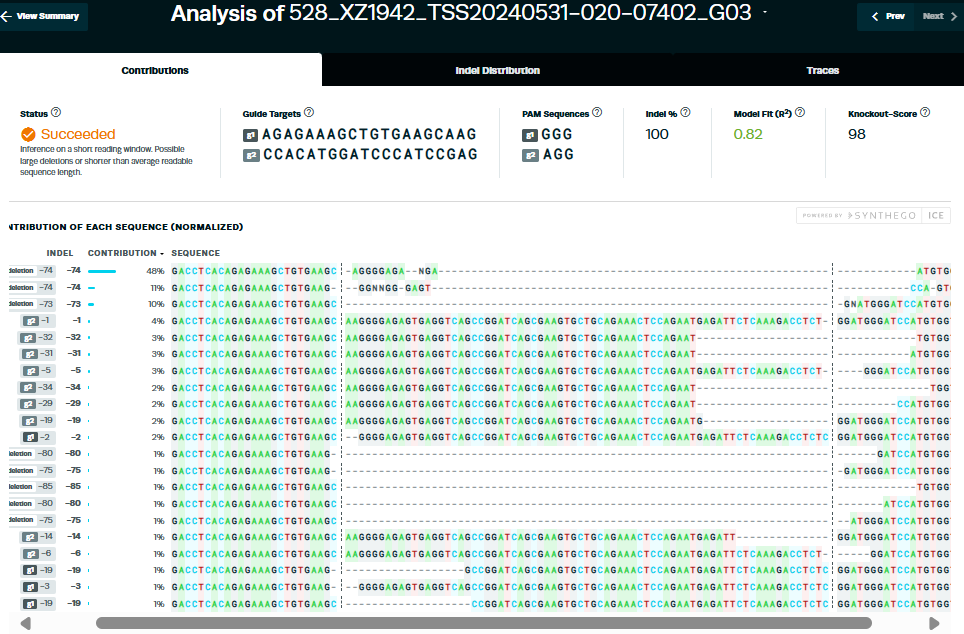
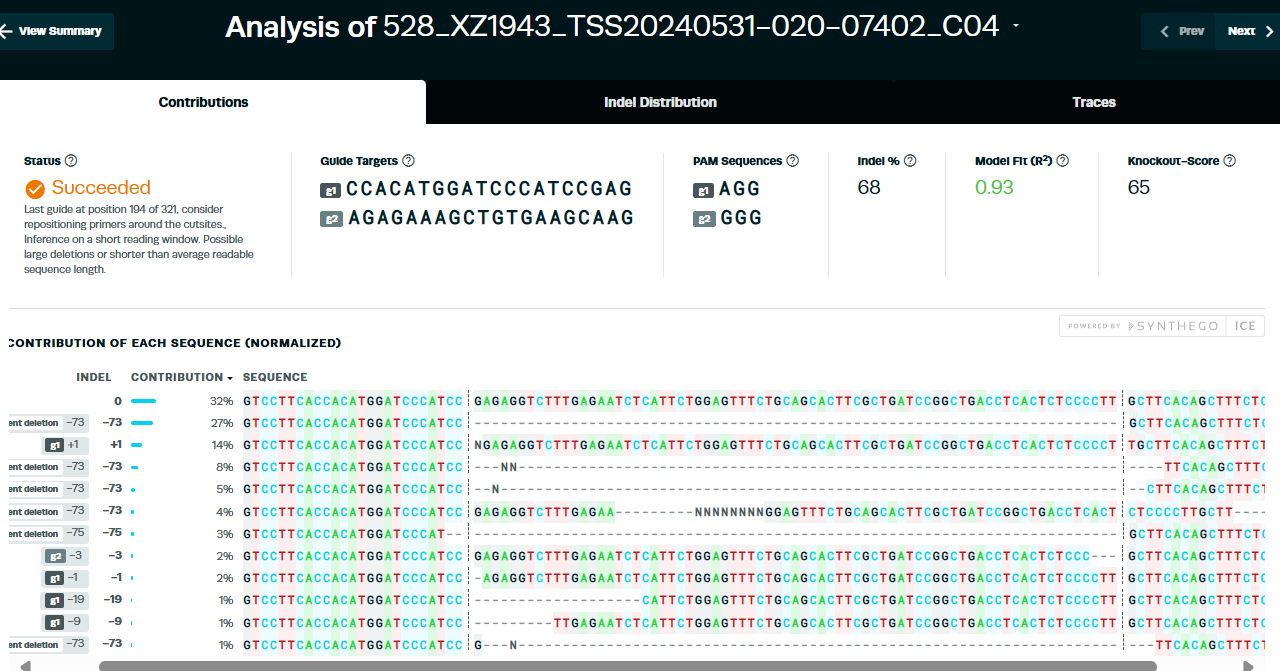
2. 编辑效率
① sgRNA-1的编辑效率为100%(约98%有效)
② sgRNA-2的编辑效率为68%(约65%有效)
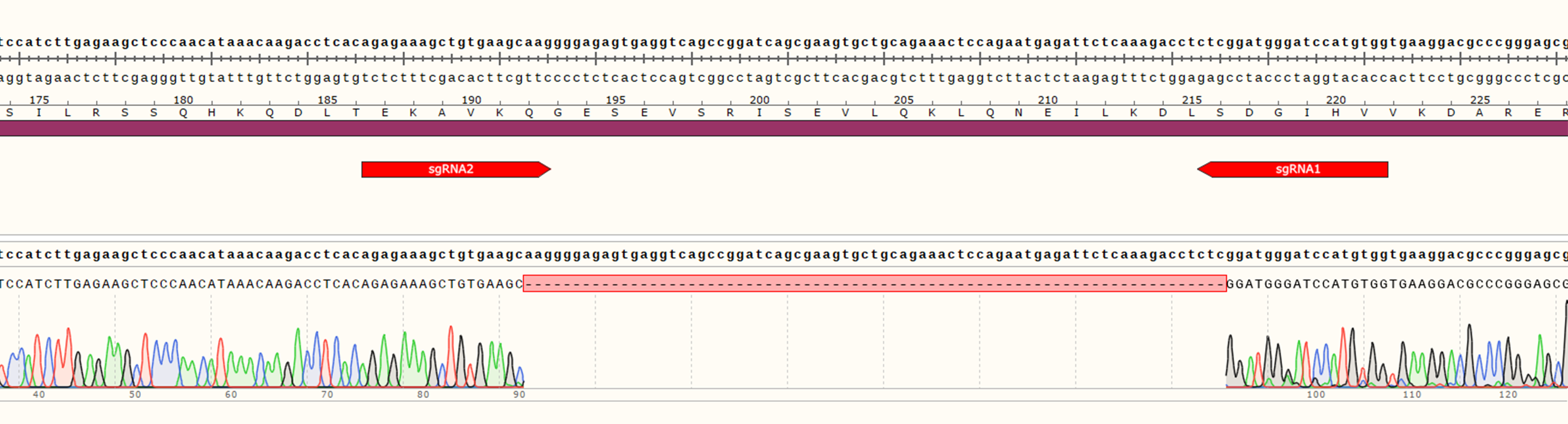
3. 测序验证
单克隆细胞株的测序验证结果显示,在A基因的sgRNA靶向位点处发生了73个碱基对的缺失(非3倍数缺失),可引起移码突变,敲除成功。
参考文献
1.皮肤鳞状细胞癌细胞(SCC)中敲除BRD4基因
近年来,皮肤鳞状细胞癌的发病率以惊人的速度上升,皮肤鳞状细胞癌和其它非黑色素瘤皮肤癌每年都会导致大量的人类死亡。统计研究表明,超过20%的世界人口在一生中可能会发展成皮肤癌,目前的治疗选择包括手术、放疗和/或化疗的组合,但对于晚期和/或转移性皮肤鳞状细胞癌的预后仍然不令人满意。最近的癌症研究提出BRD4可能是一个潜在的致癌蛋白,但其在皮肤鳞状细胞癌中的表达和生物学功能尚未被研究。
研究人员开展了分子靶向治疗的研究,使用CRISPR/Cas9系统直接敲除BRD4基因。BRD4基因的敲除或沉默显著降低了皮肤鳞状细胞癌细胞(SCC)的增殖能力,导致SCC细胞中几个与细胞增殖密切相关的癌基因(如cyclin D1、Bcl-2和MYC)的表达显著下降。在体内实验中,通过CRISPR/Cas9介导的BRD4基因敲除显著抑制了A431细胞在严重联合免疫缺陷(SCID)小鼠中的肿瘤生长。BRD4基因敲除细胞为进一步的临床研究和药物开发提供了科学依据,有助于开发针对BRD4的分子靶向治疗药物。
2.MDA-MB-231乳腺癌细胞中敲除成纤维细胞生长因子受体1(FGFR1)
成纤维细胞生长因子(Fibroblast Growth Factor, FGF)—成纤维细胞生长因子受体(Fibroblast Growth Factor Receptor, FGFR)信号轴是介导肿瘤基质与癌细胞之间相互作用的主要信号传导途径之一,FGFR1的激活可以通过转位、点突变或FGFR1基因的扩增导致癌症恶化。此外,G蛋白偶联雌激素受体(GPER, GPR30)也被确认为介导雌激素在多种病理生理条件下作用的受体。
为探索GPER如何通过FGF2/FGFR1信号轴介导CAFs与乳腺癌细胞之间的通讯,研究人员使用了CRISPR/Cas9基因编辑技术来敲除MDA-MB-231乳腺癌细胞中的成纤维细胞生长因子受体1(FGFR1),正常对照组中来自雌激素刺激的癌症相关成纤维细胞(CAFs)的条件培养基(CM)能够诱导FGFR1野生型(WT)MDA-MB-231细胞中CTGF(结缔组织生长因子)的表达,并通过FGFR1-ERK1/2-AKT信号通路促进细胞的迁移和侵袭。而在FGFR1基因敲除的MDA-MB-231细胞中,这种诱导作用则显著降低或消失。FGFR1基因敲除细胞揭示了GPER在肿瘤微环境中调节FGF2表达的新角色,证实了FGFR1在乳腺癌中的基因扩增与患者的整体存活率密切相关,表明FGFR1可能作为乳腺癌治疗的一个靶点,阐明了CAFs与乳腺癌细胞之间的旁分泌激活作用,为开发新的治疗策略提供了理论基础。
3.Swan71细胞系中敲除BRCA1基因
在早期胎盘发育中,肿瘤抑制基因和癌基因共同工作,以一种受控的方式调节细胞增殖和分化。BRCA1是一个已知的肿瘤抑制基因,它与ZNF350和CtIP形成复合体,结合到HMGA2基因的启动子区域,阻止其转录。这种调控在癌症细胞中已有研究,但在胎盘细胞中的研究较少。
研究人员使用CRISPR-Cas9系统在Swan71细胞系中敲除BRCA1基因,生成了BRCA1基因敲除(BRCA1 KO)细胞,通过感染Swan71细胞与含有miR-182过表达构建的慢病毒颗粒,使miR-182在细胞中过表达。结果显示,与野生型细胞相比,BRCA1 KO细胞显示出显著增加的HMGA2 mRNA和蛋白水平;miR-182的过表达导致BRCA1蛋白水平下降,HMGA2蛋白水平上升。BRCA1基因敲除细胞表明BRCA1在调节滋养层细胞中的HMGA2水平方面发挥重要作用,并且可能通过影响细胞凋亡参与胎盘的发育和功能,为理解BRCA1在胎盘发育中的作用提供了新的视角。
4.NGP和CHP-134 NB细胞系中敲除ATM基因
神经母细胞瘤(Neuroblastoma, NB)是一种常见的儿童实体瘤,临床表现和预后具有高度的异质性,尽管采用了多种治疗策略,但高风险NB患者的肿瘤对标准治疗存在抵抗性,并可能发展成转移。ATM基因与DNA损伤反应有关,位于11q的ATM基因的杂合性缺失和ATM基因的半合性突变在NB肿瘤中是互斥的。在NB细胞系中,ATM的敲低已被证明可以在体外和体内促进肿瘤形成,但ATM与肿瘤形成和癌症侵袭性之间的关联尚不清楚。
研究人员使用CRISPR/Cas9技术敲除了NGP和CHP-134 NB细胞系中的ATM基因,分析ATM基因敲除细胞的增殖和集落形成能力,Western blot检测与DNA修复途径相关的不同蛋白的表达,并在ATM基因敲除细胞中稳定转染FANCD2表达质粒以过表达FANCD2,免疫荧光显微确定蛋白表达情况。结果显示,ATM的缺失导致FANCD2蛋白水平下降,完全ATM基因敲除细胞对PARP抑制剂奥拉帕尼表现出更高的敏感性,在ATM基因敲除细胞中重新引入FANCD2表达,可以恢复细胞的增殖能力。ATM基因敲除细胞揭示了ATM基因杂合性在神经母细胞瘤中的作用机制,并阐明了ATM失活如何增强NB细胞对奥拉帕尼治疗的敏感性,对治疗显示ATM基因剂量和侵袭性癌症进展的高风险NB患者具有重要意义。

 DeepBio得分:5567.2
DeepBio得分:5567.2
 DeepBio得分
是基于文献引用次数,影响因子,文献新近度等因素计算的客观产品评级,得分越高表明该产品经过越可靠的实验验证,质量可信度越高
DeepBio得分
是基于文献引用次数,影响因子,文献新近度等因素计算的客观产品评级,得分越高表明该产品经过越可靠的实验验证,质量可信度越高